系列综述——微管生长动力学及其数值模拟 Day 3
2016年04月15日 微管 综述 科学 学术 思 添加评论上接Day 2。
本系列章节、图表、引文均连续编号。
2. 微管静态特性的研究现状
微管静态特性的研究内容主要为两方面:一为高分辨率的微管蛋白及微管结构解析,二为微管力学特性的实验测定与理论分析。
2.1. 微管的结构解析
电子晶体学和冷冻(低温)电镜技术(结合三维图像重建)是目前解析微管结构的两种主要手段。相比于早期的x射线晶体学 (16, 17),电子显微技术更方便得到分辨率更高的图样 (8, 18, 19)。电子晶体学的一个显著缺点是对样品的辐射损伤,并且观测时的非生理环境也会导致样品变形。之后发展的冷冻电镜技术缓解了这个难题,它将样品在液氮甚至液氦温度下进行冷冻,允许在自然环境中观测试样,而无需额外的固定或染色。当然,如此理想的实验环境是以牺牲分辨率为代价的,一般,需要结合更精细的蛋白质晶体学数据,才能合理地解读冷冻电镜图像。
电子衍射和透射电镜分析要求试样足够薄,以保证电子能够穿透,三维的微管结构显然不是最理想的。不过,虽然溶液中的微管蛋白能自发组装成为标准的微管结构,但在$\rm Zn^{2+}$环境中,微管蛋白却能构成非常有利于高分辨电子显微的二维晶体片 (16, 20)。这种晶片的相邻原丝反向排列,原丝结构与微管原丝类似,数目一般不超过$12$。在加入紫杉醇后,蛋白结构变的更为稳定,更利于结构解析 (21)。基于对此种薄片结构的分析,微管蛋白结构的分辨率的得以提高至$3.5 ~ \rm Å$ (22),蛋白功能域 (18),FtsZ蛋白结构 (8),紫杉醇作用位点 (22) 等均得到了澄清。然而,由于晶片中的原丝是反向连接的,其高分辨率的结构却并不能提供任何真实微管的横向相互作用信息 (23, 24),而横向键对于微管的静力学性质和动态行为都是至关重要的。得到完整微管结构信息的一个思路是将精细的微管蛋白晶体结构填入到根据冷冻电镜结果重建的、较粗分辨率的三维图像中 (25)。三维重建技术和蛋白信息填入方法的改进带来最终结果的不断精细化。螺旋技术和后投影技术是结构三维重建的主要手段 (23),非$13$原丝微管由于原丝的整体绕轴扭转,其单张图片即包含多个角度的信息 (26),在结构解析中更受青睐。通过后投影方法,Sosa重建了有马达蛋白作用的三维微管结构,可以看清马达与微管蛋白作用的细节,以及清晰的包含缝的微管晶格结构 (27);通过螺旋重建法及蛋白结构充填,Meurer-Grob得到了分辨率为$14 ~ \rm Å$的微管结构 (24);通过改进的单粒子结构重建法,Li将分辨率进一步提高到$8 ~ \rm Å$ (23);Krebs则在将蛋白数据填入微管后,对两种蛋白单体的位置分别作了刚性修正,以区分$\alpha$和$\beta$蛋白的结构差异 (28, 29)。尽管结构解析的精度不断在提升,但是目前还是无法分辨单个氨基酸间的相互作用,也不足以辨明纵向疏水作用和横向静电力作用的细节。
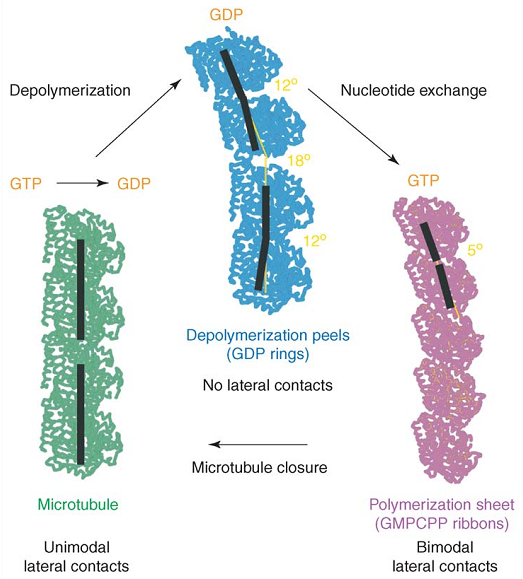
微管结构解析的一个重要成果是辨明了结合GTP的微管蛋白(GTP-t)与结合GDP的微管蛋白(GDP-t)在结构上的差异。真实的微管或二维片状原丝的构型中,由于存在晶格的约束,两类微管蛋白的构型是相似的。要能够辨别自然的微管蛋白构型,就必须考虑微管蛋白其他的聚合状态。OP18/Stathmin是一种对微管具有去稳作用的结合蛋白,它能与两个微管蛋白二聚体形成复合物,为研究微管蛋白的构型提供了渠道。对该种三元复合物的分析表明,水解后的二聚体在其内部和两两之间都会产生角度的偏折 (30, 31)。Nogales和她的研究组在没有附加蛋白帮助的情况下,直接确定了核苷酸状态对二聚体构型的影响,并对二聚体内部和二聚体之间的界面区别作了更为清晰的展示 (32):在二价阳离子环境中,GDP-t易于组成环状结构,虽不能成管,但却可以排列成不闭合的一单体头数双层螺旋管状结构。对此种结构的分析表明,水解的亚基呈现弯曲的构型,在二聚体内和二聚体间分别有约$12°$和$18°$的折角,这种弯曲与微管的结构是不相容的;亚基内部GTP界面与亚基间的GDP界面是完全不同的。GMPCPP是GTP的一种不会发生水解的同系物,由其结合的微管蛋白也能组装成为微管,虽然GMPCPP微管的纵向周期是$4.3 ~ \rm {nm}$ (33) ,异于GTP微管的$4 ~ \rm{nm}$,但一般认为此差异是GTP水解与否导致的,故而GMPCPP-t还是被广泛用于微管的体外研究中。实验发现,在低温下,GMPCPP微管蛋白会组装成一种带状结构,这种结构中的原丝两两成对,每对内的横向相互作用与微管中的是相似的,而对与对之间却是另一种相互作用。这种结构的曲率明显小于GDP-t,其纵向的弯曲大约为$5°$。不同核苷酸状态的微管蛋白的构型示于图6 (34)。作者认为,这种带状结构与微管生长中的中间结构密切相关,并据此提出了对微管生长过程中构型转变的猜测。
通过大量的微管结构解析,微管的基本构造(即原丝横向错位排列成的手型管状结构)确定无疑,螺旋晶格也清晰可辨。但是其中也发现了一些不同寻常的现象,Chrétien的微管组装实验 (35) 显示,同一微管的原丝数并不是固定的,沿纵向可以发生类似晶体位错的改变,并且这种变化在作者考察的聚合系统中普遍存在。原丝数目的变化大多是连续的,但也发现了以$2$递增的跳跃。事实上,在体外聚合过程中,影响微管原丝数目的因素繁多而复杂,包括:温度、溶液pH值、缓冲液类型、形核模板、蛋白来源细胞、蛋白纯化过程,等等。Kikkawa运用急冻深刻蚀电子显微技术首次给出了微管晶格中有缝($\alpha -\beta$横向连接)存在的直接证据;实验同时观察到有的微管上有两条缝存在,通过分析蛋白的排列可知,实际应该共有三条缝 (36)。这些特殊的微管结构虽然成因不明,但一定暗示着关于微管的生长过程的信息。
参考文献:
(8) Nogales, E., Downing, K. H., Amos, L. A., and Lowe, J. (1998) Tubulin and FtsZ form a distinct family of GTPases, Nature Structural Biology 5, 451-458.
(16) Amos, L. A., and Baker, T. S. (1979) 3-dimensional structure of tubulin protofilaments, Nature 279, 607-612.
(17) Metoz, F., and Wade, R. H. (1997) Diffraction by Helical Structures with Seams: Microtubules, Journal of Structural Biology 118, 128-139.
(18) Nogales, E., Wolf, S. G., and Downing, K. H. (1998) Structure of the alpha beta tubulin dimer by electron crystallography, Nature 391, 199-203.
(19) Nogales, E., Wolf, S. G., Khan, I. A., Luduena, R. F., and Downing, K. H. (1995) Structure of tubulin at 6.5 angstrom and location of the taxol-binding site, Nature 375, 424-427.
(20) Gaskin, F., and Kress, Y. (1977) Zinc ion-induced assembly of tubulin, Journal of Biological Chemistry 252, 6918.
(21) Nogales, E., Wolf, S. G., Zhang, S. X., and Downing, K. H. (1995) Preservation of 2-D Crystals of Tubulin for Electron Crystallography, Journal of Structural Biology 115, 199-208.
(22) Lowe, J., Li, H., Downing, K. H., and Nogales, E. (2001) Refined structure of alpha beta-tubulin at 3.5 A resolution, Journal of Molecular Biology 313, 1045-1057.
(23) Li, H. L., DeRosier, D. J., Nicholson, W. V., Nogales, E., and Downing, K. H. (2002) Microtubule structure at 8 angstrom Resolution, Structure 10, 1317-1328.
(24) Meurer-Grob, P., Kasparian, J., and Wade, R. H. (2001) Microtubule structure at improved resolution, Biochemistry 40, 8000-8008.
(25) Nogales, E., Whittaker, M., Milligan, R., and Downing, K. (1999) High-resolution model of the microtubule, Cell 96, 79-88.
(26) Wade, R. H., and Chretien, D. (1993) Cryoelectron microscopy of microtubules, Journal of Structural Biology 110, 1-27.
(27) Sosa, H., and Milligan, R. A. (1996) Three-dimensional structure of ncd-decorated microtubules obtained by a back-projection method, Journal of Molecular Biology 260, 743-755.
(28) Krebs, A., Goldie, K. N., and Hoenger, A. (2004) Complex formation with kinesin motor domains affects the structure of microtubules, Journal of Molecular Biology 335, 139-153.
(29) Krebs, A., Goldie, K. N., and Hoenger, A. (2005) Structural rearrangements in tubulin following microtubule formation, EMBO Reports 6, 227-232.
(30) Gigant, B., Curmi, P., Martin-Barbey, C., Charbaut, E., Lachkar, S., Lebeau, L., Siavoshian, S., Sobel, A., and Knossow, M. (2000) The 4 X-ray structure of a tubulin: stathmin-like domain complex, Cell 102, 809-816.
(31) Steinmetz, M. O., Kammerer, R. A., Jahnke, W., Goldie, K. N., Lustig, A., and van Oostrum, J. (2000) Op18/stathmin caps a kinked protofilament-like tubulin tetramer, EMBO Journal 19, 572-580.
(32) Wang, H. W., and Nogales, E. (2005) Nucleotide-dependent bending flexibility of tubulin regulates microtubule assembly, Nature 435, 911-915.
(33) Hyman, A. A., Chretien, D., Arnal, I., and Wade, R. H. (1995) Structural-changes accompanying gtp hydrolysis in microtubules - Information from a slowly hydrolyzable analog guanylyl-(alpha,beta)-methylene-diphosphonate, Journal of Cell Biology 128, 117-125.
(34) Nogales, E., and Wang, H. W. (2006) Structural mechanisms underlying nucleotide-dependent self-assembly of tubulin and its relatives, Current Opinion in Structural Biology 16, 221-229.
(35) Chretien, D., Metoz, F., Verde, F., Karsenti, E., and Wade, R. H. (1992) Lattice-defects in microtubules - protofilament numbers vary within individual microtubules, Journal of Cell Biology 117, 1031-1040.
(36) Kikkawa, M., Ishikawa, T., Nakata, T., Wakabayashi, T., and Hirokawa, N. (1994) Direct visualization of the microtubule lattice seam both in-vitro and in-vivo, Journal of Cell Biology 127, 1965-1971.
